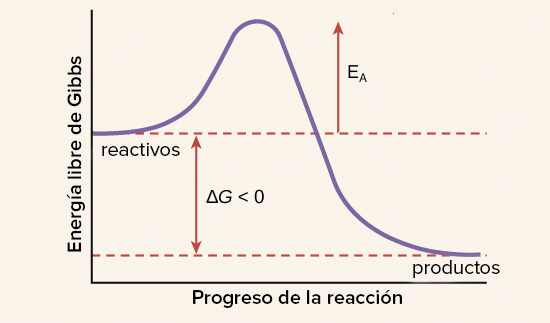
LA ENERGÍA DE ACTIVACIÓN:
Este aporte de energía inicial, que posteriormente se compensa conforme progresa la reacción, se llama energía de activación y se abrevia AE.
La fuente de energía de activación normalmente es el calor, esto es, las moléculas de reactivo absorben la energía térmica de su entorno.
Esta energía térmica acelera el movimiento de las moléculas de reactivo, incrementa la frecuencia y la fuerza de sus colisiones, y también agita los átomos y enlaces dentro de las moléculas individuales, por lo que aumenta la probabilidad de que los enlaces se rompan. Una vez que una molécula de reactivo absorbe suficiente energía para alcanzar el estado de transición, puede continuar con el resto de la reacción.
No hay comentarios.:
Publicar un comentario