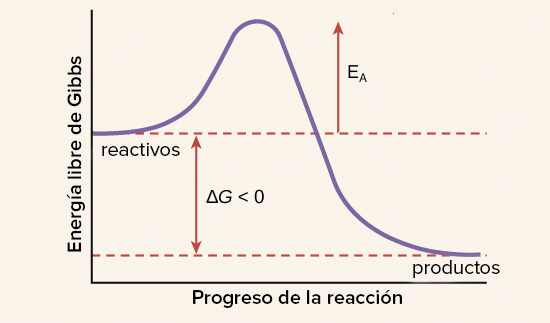
ENERGÍA DE REACCIÓN Y LA VELOCIDAD DE REACCIÓN:
En toda reacción química se absorbe o desprende energía (normalmente como calor o luz). Esto se debe a que al romperse y formarse enlaces se absorbe y se desprende energía respectivamente. Según criterios energéticos las reacciones se clasifican en:
EXOTERMICAS:
La energía liberada en los nuevos enlaces que se forman es mayor que la empleada en los enlaces que se rompen.
ENDOTERMICAS:
La energía absorbida en los enlaces que se rompen es mayor que la desprendida en los enlaces que se forman
VELOCIDAD DE REACCIÓN:
La velocidad de reacción se define como el cambio en la concentración de uno de los reactivos o productos, en un intervalo de tiempo en el cual tiene lugar el cambio. Lo anterior, permite saber la velocidad promedio de la reacción.
Por lo tanto, la velocidad de reacción es función de los reactivos, de la temperatura a la que se efectúa la reacción, de la superficie expuesta entre los reactivos, de la concentración de los reactivos, y en algunas ocasiones, de los catalizadores.